Skandioa, Sc elementuaren ikurra eta 21 zenbaki atomikoa dituena, erraz disolbagarria da uretan, ur beroarekin elkarreragin dezake eta erraz iluntzen da airean. Bere balentzia nagusia +3 da. Askotan gadolinioarekin, erbioarekin eta beste elementu batzuekin nahasten da, etekin txikiarekin eta lurrazalean % 0,0005 inguruko edukiarekin. Eskandioa askotan erabiltzen da beira bereziak eta tenperatura altuko aleazio arinak egiteko.
Gaur egun, munduko eskandio erreserba frogatuak 2 milioi tona baino ez dira, eta horien % 90-95 bauxita, fosforita eta burdin titanio meetan daude, eta zati txiki bat uranio, torio, tungsteno eta lur arraroen meetan, batez ere Errusian, Txinan, Tajikistanen, Madagaskarren, Norvegian eta beste herrialde batzuetan banatuta. Txina oso aberatsa da eskandio baliabideetan, eskandioarekin lotutako mineral erreserba izugarriekin. Estatistika osatugabeen arabera, Txinako eskandio erreserbak 600.000 tona ingurukoak dira, eta hauek bauxita eta fosforita gordailuetan, porfiro eta kuartzo zain tungsteno gordailuetan daude Txina hegoaldean, lur arraroen gordailuetan Txina hegoaldean, Bayan Obo lur arraroen burdin mearen gordailuan Barne Mongolian eta Panzhihua banadio titanio magnetita gordailuan Sichuanen.
Eskandioaren urritasunagatik, eskandioaren prezioa ere oso altua da, eta bere gorenean, eskandioaren prezioa urrearen prezioaren 10 aldiz puztu zen. Eskandioaren prezioa jaitsi den arren, oraindik urrearen prezioaren lau aldiz handiagoa da!
Historia ezagutzen
1869an, Mendeleievek kaltzioaren (40) eta titanioaren (48) artean masa atomikoko hutsune bat ikusi zuen, eta bertan tarteko masa atomikoko elementu aurkitu gabe bat ere bazegoela iragarri zuen. Bere oxidoa X ₂ O Å dela iragarri zuen. Eskandioa 1879an aurkitu zuen Lars Frederik Nilsonek, Suediako Uppsala Unibertsitatekoak. Urre beltz arraroaren meategitik atera zuen, 8 metal oxido mota dituen mea konplexu batetik. Atera duErbio(III) oxidoaurre-mea beltz arraro batetik lortua, eta lortuaYterbio(III) oxidoaoxido honetatik, eta elementu arinago baten beste oxido bat dago, zeinaren espektroak metal ezezaguna dela erakusten duen. Mendeleievek iragarritako metala da hau, zeinaren oxidoa denSc₂O₃Eskandio metala bera hemendik ekoitzi zenEskandio kloruroa1937an urtze elektrolitikoa erabiliz.
Mendeleev
Konfigurazio elektronikoa
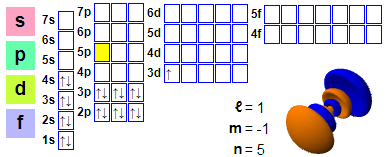
Konfigurazio elektronikoa: 1s² 2s² 2p6 3s² 3p6 4s² 3d1
Eskandioa trantsizio-metal zuri eta zilarkara bat da, 1541 ℃-ko urtze-puntua eta 2831 ℃-ko irakite-puntua dituena.
Aurkikuntzaren ondoren denbora luzez, eskandioaren erabilera ez zen frogatu, ekoizpenean zuen zailtasunagatik. Lur arraroen elementuen bereizketa-metodoen hobekuntza gero eta handiagoarekin, eskandio-konposatuak arazteko prozesu-fluxu heldu bat dago orain. Eskandioa itrioa eta lantanidoa baino alkalino gutxiago denez, hidroxidoa da ahulena, beraz, eskandioa duen lur arraroen elementuen nahasketa-mineralak lur arraroetatik bereiziko dira "maila-prezipitazio" metodoaren bidez, Eskandio(III) hidroxidoa amoniakoarekin tratatzen denean disoluziora eraman ondoren. Beste metodoa Eskandio nitratoa nitratoaren deskonposizio polarraren bidez bereiztea da. Eskandio nitratoa deskonposatzen errazena denez, eskandioa bereiz daiteke. Horrez gain, uranio, torio, tungsteno, eztainu eta beste mineral-gordailu batzuetatik datorren eskandioaren berreskurapen osoa ere eskandio-iturri garrantzitsua da.
Eskandio konposatu purua lortu ondoren, ScCl Å bihurtzen da eta KCl eta LiCl-rekin urtzen da. Zink urtua elektrolisirako katodo gisa erabiltzen da, eskandioa zink elektrodoan prezipitatzea eraginez. Ondoren, zinka lurrundu egiten da eskandio metalikoa lortzeko. Zilar koloreko metal zuri arina da, propietate kimiko oso aktiboak dituena, ur beroarekin erreakzionatu dezakeena hidrogeno gasa sortzeko. Beraz, irudian ikusten duzun eskandio metalikoa botila batean sartzen da eta argon gasarekin babesten da, bestela eskandioek azkar eratuko dute oxido geruza hori ilun edo gris bat, bere distira metaliko distiratsua galduz.
Aplikazioak
Argiztapen industria
Eskandioaren erabilerak norabide oso distiratsuetan kontzentratzen dira, eta ez da gehiegikeria Argiaren Semea deitzea. Eskandioaren lehen arma magikoa eskandio sodio lanpara da, milaka etxetara argia eramateko erabil daitekeena. Hau haluro metalikozko argi elektrikoa da: bonbilla sodio ioduroz eta eskandio triioduroz betetzen da, eta eskandioa eta sodio papera gehitzen zaizkio aldi berean. Tentsio handiko deskargan, eskandio ioiek eta sodio ioiek, hurrenez hurren, beren igorpen-uhin-luzera bereizgarriko argia igortzen dute. Sodioaren espektro-lerroak 589,0 eta 589,6 nm dira, bi argi hori ospetsu, eta eskandioarenak, berriz, 361,3~424,7 nm dira, ultramore hurbileko eta urdineko argi-igorpenen serie bat. Elkarren osagarri direnez, sortutako argi-kolore orokorra argi zuria da. Hain zuzen ere, eskandio sodiozko lanparek argi-eraginkortasun handiko, argi-kolore oneko, energia-aurrezleko, zerbitzu-bizitza luzeko eta lainoa hausteko gaitasun handiko ezaugarriak dituztelako, telebistako kameretan, plazetan, kirol-instalazioetan eta errepideetako argiztapenean erabil daitezke, eta hirugarren belaunaldiko argi-iturri gisa ezagutzen dira. Txinan, lanpara mota hau pixkanaka sustatzen ari da teknologia berri gisa, eta herrialde garatu batzuetan, berriz, lanpara mota hau 1980ko hamarkadaren hasieran erabili zen.
Eskandioaren bigarren arma magikoa eguzki-zelula fotovoltaikoak dira, lurrean barreiatutako argia bildu eta elektrizitate bihur dezaketenak gizartea bultzatzeko. Eskandioa metal isolatzaile, erdieroale siliziozko eguzki-zeluletan eta eguzki-zeluletan hesi-metal onena da.
Hirugarren arma magikoari γ A izpien iturria deitzen zaio. Arma magiko honek bere kabuz distira handia egin dezake, baina argi mota hau ezin da begi hutsez jaso, energia handiko fotoi-fluxua da. Normalean 45Sc mineraletatik ateratzen dugu, eskandioaren isotopo natural bakarra baita. 45Sc nukleo bakoitzak 21 protoi eta 24 neutroi ditu. 46Sc, isotopo erradioaktibo artifiziala, γ erradiazio-iturri edo trazatzaile-atomo gisa erabil daiteke tumore gaiztoen erradioterapian ere. Itrio, galio, eskandio, granate laser bezalako aplikazioak ere badaude.Eskandio fluoruroabeirazko infragorri zuntz optikoa eta eskandioz estalitako katodo izpien hodia telebistan. Badirudi eskandioa distira batekin jaio dela.
Aleazioen industria
Eskandioa, bere forma elementalean, asko erabili izan da aluminiozko aleazioak dopatzeko. Eskandioaren milaren batzuk gehitzen zaizkion bitartean aluminioari, Al3Sc fase berri bat sortuko da, eta horrek metamorfismo-rola izango du aluminiozko aleazioan eta aleazioaren egitura eta propietateak nabarmen aldatuko ditu. % 0,2~% 0,4 Sc gehitzeak (etxean frijitutako barazkiei gatza gehitzeko proportzioaren oso antzekoa da, pixka bat besterik ez da behar) aleazioaren birkristalizazio-tenperatura 150-200 ℃-tan handitu dezake, eta nabarmen hobetu tenperatura altuko erresistentzia, egitura-egonkortasuna, soldadura-errendimendua eta korrosioarekiko erresistentzia. Gainera, tenperatura altuetan lan luzeetan gerta daitekeen hauskortasun-fenomenoa saihestu dezake. Erresistentzia eta gogortasun handiko aluminiozko aleazioak, korrosioarekiko erresistentzia handiko aluminiozko soldagarri berriek, tenperatura altuko aluminiozko aleazio berriek, neutroi-irradiazioarekiko erresistentzia handiko aluminiozko aleazioek, etab., garapen-aukera oso erakargarriak dituzte aeroespazialean, hegazkingintzan, itsasontzietan, erreaktore nuklearretan, ibilgailu arinen eta abiadura handiko trenetan.
Eskandioa burdinaren aldatzaile bikaina da, eta eskandio kantitate txiki batek burdinurtuaren erresistentzia eta gogortasuna nabarmen hobetu ditzake. Horrez gain, eskandioa tenperatura altuko tungsteno eta kromo aleazioetarako gehigarri gisa ere erabil daiteke. Jakina, besteentzako ezkontza-arropak egiteaz gain, eskandioek urtze-puntu altua du eta bere dentsitatea aluminioaren antzekoa da, eta urtze-puntu altuko aleazio arinetan ere erabiltzen da, hala nola eskandio titaniozko aleazioan eta eskandio magnesiozko aleazioan. Hala ere, bere prezio altua dela eta, oro har, goi-mailako fabrikazio-industrietan bakarrik erabiltzen da, hala nola espazio-ontzietan eta suzirietan.
Zeramikazko materiala
Eskandioa, substantzia bakarra, aleazioetan erabiltzen da normalean, eta haren oxidoek paper garrantzitsua betetzen dute zeramikazko materialetan, modu berean. Zirkonio tetragonal zeramikozko materialak, oxido solidozko erregai-pilen elektrodo-material gisa erabil daitekeenak, propietate berezi bat du: elektrolito honen eroankortasuna handitzen da tenperatura eta oxigeno-kontzentrazioa handitzen diren heinean. Hala ere, zeramikazko material honen kristal-egitura bera ezin da egonkor mantendu eta ez du balio industrialik; egitura hori finkatu dezaketen substantzia batzuk dopatu behar dira bere jatorrizko propietateak mantentzeko. % 6~10 eskandio oxidoa gehitzea hormigoi-egitura baten antzekoa da, zirkonioa sare karratu batean egonkortu daitekeelako.
Badira ingeniaritzarako zeramikazko materialak ere, hala nola, erresistentzia handiko eta tenperatura altuko silizio nitruroa, dentsifikatzaile eta egonkortzaile gisa.
Dentsifikatzaile gisa,Eskandio oxidoaSc2Si2O7 fase errefraktario bat sor dezake partikula finen ertzean, eta horrela, ingeniaritza-zeramiken tenperatura altuko deformazioa murriztu. Beste oxido batzuekin alderatuta, silizio nitruroaren tenperatura altuko propietate mekanikoak hobeto hobetu ditzake.
Kimika katalitikoa
Ingeniaritza kimikoan, eskandioa askotan katalizatzaile gisa erabiltzen da, Sc2O3 etanolaren edo isopropanolaren deshidratazio eta desoxidaziorako, azido azetikoaren deskonposiziorako eta CO eta H2-tik etilenoa ekoizteko erabil daitekeen bitartean. Sc2O3 duen Pt Al katalizatzailea ere katalizatzaile garrantzitsua da petrolio astunen hidrogenazio, arazketa eta fintze prozesuetarako industria petrokimikoan. Kumeno bezalako erreakzio katalitikoetan, Sc-Y zeolita katalizatzailearen jarduera aluminio silikato katalizatzailearena baino 1000 aldiz handiagoa da; Katalizatzaile tradizional batzuekin alderatuta, eskandio katalizatzaileen garapen aukerak oso distiratsuak izango dira.
Energia nuklearraren industria
Tenperatura altuko erreaktore nuklearreko UO2-ri Sc2O3 kantitate txiki bat gehitzeak UO2-tik U3O8-ra bihurtzeak eragindako sare-eraldaketa, bolumenaren igoera eta pitzadurak saihestu ditzake.
Erregai-pila
Era berean, nikel alkalino bateriei % 2,5etik % 25era eskandioa gehitzeak haien bizitza erabilgarria handituko du.
Nekazaritza-hazkuntza
Nekazaritzan, artoa, erremolatxa, ilarra, garia eta ekilore bezalako haziak eskandio sulfatoarekin trata daitezke (kontzentrazioa normalean 10-3~10-8mol/L da, landare ezberdinek desberdina izango dute), eta ernetzea sustatzeko benetako efektua lortu da. 8 ordu igaro ondoren, sustraien eta kimuen pisu lehorra % 37 eta % 78 handitu zen, hurrenez hurren, plantulekin alderatuta, baina mekanismoa oraindik aztergai dago.
Nielsenek masa atomikoaren datuen zorrari eskaini zion arretatik gaur egun arte, eskandioa ehun edo hogei urtez bakarrik sartu da jendearen ikuspegian, baina ia ehun urtez egon da bankuan. Materialen zientziaren garapen indartsua izan zen azken mendearen amaieran arte ez zion bizitasuna eman. Gaur egun, lur arraroen elementuak, eskandioa barne, materialen zientziako izar beroak bihurtu dira, milaka sistematan etengabe aldatzen ari diren rolak betetzen dituzte, egunero erosotasun handiagoa ekarriz gure bizitzara, eta neurtzeko are zailagoa den balio ekonomikoa sortuz.
Argitaratze data: 2023ko ekainaren 29a